Nedílnou součástí života je proces stárnutí, které provázejí nejrůznější efekty vedoucí k postupné degradaci mnoha orgánů. Výzkumy sledující stárnutí na buněčné úrovni ukazují na univerzální mechanismus, kterým je řízeno zkracování telomer a poškození energetického metabolismu buňky v mitochondriích.
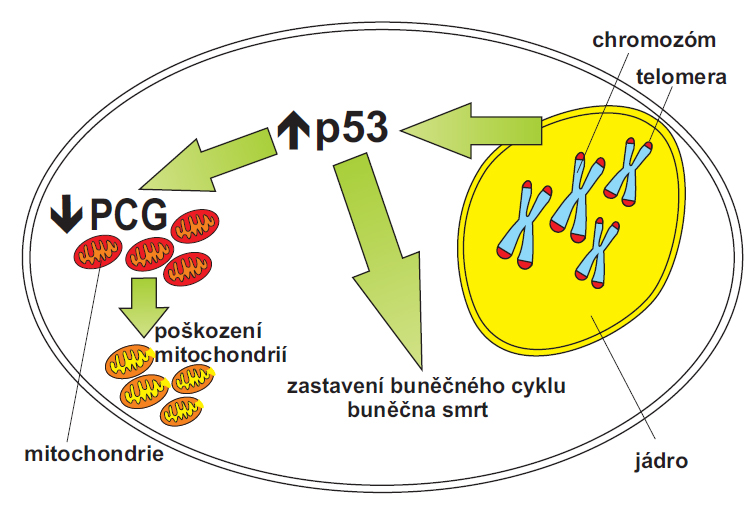 S přibývajícím věkem dochází k poškozování chromozomů a zkracování jejich koncových částí, které se nazývají telomery (viz obrázek). Telomery – komplexy proteinů s DNA na koncích chromozomů chrání jejich integritu. Buněčnou odpovědí na poškození DNA v chromozomech a na zkrácení telomer je aktivace celé řady kontrolních mechanismů buňky, které buňku chrání před nádorovým bujením a před kumulací chyb v DNA. Jedním z nejobvyklejších mechanismů je aktivace proteinu p53, který je odpovědný za zprostředkování zastavení buněčného cyklu (kdy má buňka příležitost před dalším dělením opravit chyby v DNA), senescenci (tedy stárnutí buňky) a apoptózu (buněčnou smrt). Nové výsledky ukazují na přímé spojení signálních drah, které vede od poškození telomer k porušení mitochondrií a nárůstu volných kyslíkových radikálů. Pomocí linií myší bez telomerázy (enzym zabraňující zkracování telomer) bylo ukázáno, že zkrácení telomer způsobuje snížení tvorby specifických mitochondriálních proteinů (PCG). Produkce těchto proteinů je nutná pro syntézu energetických molekul buňky – ATP a také pro tvorbu proteinů odstraňujících volné kyslíkové radikály. Další experimenty byly provedeny s linií, u které byl vyřazen i protein p53. Ukázalo se, že protein p53 je nutný pro přenos signálu z jádra do mitochondrií. V případě linie myší, která neměla protein p53, došlo k obnovení produkce uvedených mitochondriálních proteinů i k částečnému obnovení fyziologického stavu zkoumaných tkání. Funkce proteinu p53 je zprostředkována jeho vazbou na specifické sekvence v DNA. Počítačová analýza DNA odhalila přítomnost cílových sekvencí pro protein p53 v promotorech mitochondriálních genů PGC. Dalšími metodami molekulární biologie bylo zjištěno, že protein p53 se váže přímo na tyto promotory a způsobuje zastavení syntézy těchto genů. Vzniká tedy velmi omezené množství mitochondriálních proteinů PCG. Poprvé tak bylo demonstrováno, že protein p53 po poškození telomer přímo mění syntézu mitochondriálních proteinů PGC a spojuje tak jaderné poškození telomer s přímým poškozením mitochondií, které vede k progresivnímu zhoršení metabolismu buňky a k jejímu intenzivnímu stárnutí.
S přibývajícím věkem dochází k poškozování chromozomů a zkracování jejich koncových částí, které se nazývají telomery (viz obrázek). Telomery – komplexy proteinů s DNA na koncích chromozomů chrání jejich integritu. Buněčnou odpovědí na poškození DNA v chromozomech a na zkrácení telomer je aktivace celé řady kontrolních mechanismů buňky, které buňku chrání před nádorovým bujením a před kumulací chyb v DNA. Jedním z nejobvyklejších mechanismů je aktivace proteinu p53, který je odpovědný za zprostředkování zastavení buněčného cyklu (kdy má buňka příležitost před dalším dělením opravit chyby v DNA), senescenci (tedy stárnutí buňky) a apoptózu (buněčnou smrt). Nové výsledky ukazují na přímé spojení signálních drah, které vede od poškození telomer k porušení mitochondrií a nárůstu volných kyslíkových radikálů. Pomocí linií myší bez telomerázy (enzym zabraňující zkracování telomer) bylo ukázáno, že zkrácení telomer způsobuje snížení tvorby specifických mitochondriálních proteinů (PCG). Produkce těchto proteinů je nutná pro syntézu energetických molekul buňky – ATP a také pro tvorbu proteinů odstraňujících volné kyslíkové radikály. Další experimenty byly provedeny s linií, u které byl vyřazen i protein p53. Ukázalo se, že protein p53 je nutný pro přenos signálu z jádra do mitochondrií. V případě linie myší, která neměla protein p53, došlo k obnovení produkce uvedených mitochondriálních proteinů i k částečnému obnovení fyziologického stavu zkoumaných tkání. Funkce proteinu p53 je zprostředkována jeho vazbou na specifické sekvence v DNA. Počítačová analýza DNA odhalila přítomnost cílových sekvencí pro protein p53 v promotorech mitochondriálních genů PGC. Dalšími metodami molekulární biologie bylo zjištěno, že protein p53 se váže přímo na tyto promotory a způsobuje zastavení syntézy těchto genů. Vzniká tedy velmi omezené množství mitochondriálních proteinů PCG. Poprvé tak bylo demonstrováno, že protein p53 po poškození telomer přímo mění syntézu mitochondriálních proteinů PGC a spojuje tak jaderné poškození telomer s přímým poškozením mitochondií, které vede k progresivnímu zhoršení metabolismu buňky a k jejímu intenzivnímu stárnutí.
Protein p53 je známý především jako nádorový supresor, který brání po poškození DNA vzniku nádorového bujení. Jeho mutace je vůbec nejčastější mutací u lidských nádorů. Příliš velká aktivita proteinu p53 vede naproti tomu k předčasnému stárnutí. Je zřejmé, že rovnováha buněčného prostředí u několika stovek bilionů buněk lidského těla je regulována velice jemně a dokonale.
Čerpáno z článků: Kelly, D. P. (2011) Cell biology: Ageing theories unified. Nature 470, 342-3; Sahin, E., a kol. (2011) Telomere dysfunction induces metabolic and mitochondrial compromise. Nature 470, 359-65
Autor je pracovníkem Biofyzikálního ústavu AV ČR.